华东理工大学开发高效NADPH再生系统
发布时间:
2023-07-18
在当前的制药工业中,酶催化的氧化还原反应起着至关重要的作用。作为最常用的氢供体,烟酰胺腺嘌呤二核苷酸(NADH)和烟酰胺腺嘌呤二核苷酸磷酸(NADPH)几乎占据了生物催化氧化还原过程的90%。然而,野生烟酰胺腺嘌呤二核苷酸脱氢酶(FDH)大多数依赖于NAD,相较于其他酶类工具如葡萄糖脱氢酶,其催化活性表现较差。因此,为了实现可靠且稳健的NADPH再生系统,需要开发高效且能够利用NADP的FDH。
T4T7 解码合成生物 2023-07-18 18:45 发表于上海

在当前的制药工业中,酶催化的氧化还原反应起着至关重要的作用。作为最常用的氢供体,烟酰胺腺嘌呤二核苷酸(NADH)和烟酰胺腺嘌呤二核苷酸磷酸(NADPH)几乎占据了生物催化氧化还原过程的90%。然而,野生烟酰胺腺嘌呤二核苷酸脱氢酶(FDH)大多数依赖于NAD,相较于其他酶类工具如葡萄糖脱氢酶,其催化活性表现较差。因此,为了实现可靠且稳健的NADPH再生系统,需要开发高效且能够利用NADP的FDH。
近日,华东理工大学许建和团队在《ChemBioChem》杂志发表了题为“Engineering a Formate Dehydrogenase for NADPH Regeneration”的研究论文,报道了一个新的来自杜氏假丝酵母的甲酸脱氢酶(CdFDH),通过结构引导的理性设计使得CdFDH未展现出严格的NAD偏好性,并具有良好的NADP利用能力,能够支持不同NADPH依赖的生物催化反应。
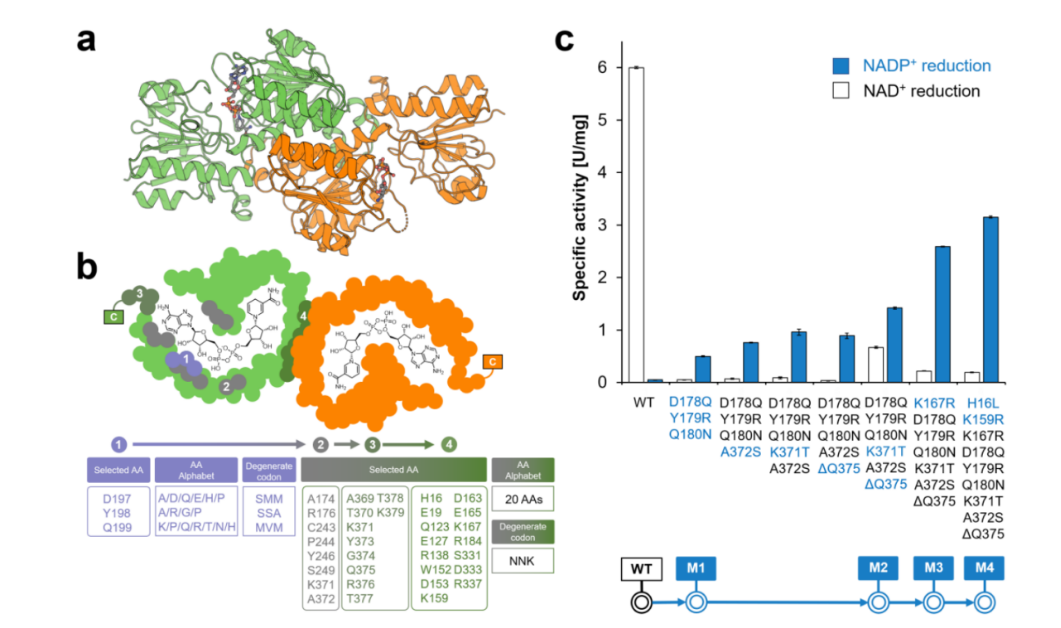
图1. CdFDH的蛋白结构和突变进化路径
在之前的研究中,该团队通过理性设计,成功改造了一个来自伯克霍尔德菌(Burkholderia stabilis)的NADP依赖性突变体(BstFDH-G146M/A287G)。然而,进一步的随机突变未能获得更高催化活性的突变体。因此,研究人员转向了其他FDHs,寻找更好的蛋白质工程起点。而CdFDH作为NADP依赖性FDH的一个全新成员,成为了理想的研究对象。通过结构引导的理性/半理性设计,CdFDH没有表现出严格的NAD依赖性,并且在构建的组合突变体CdFDH-M4(D197Q/Y198R/Q199N/A372S/K371T/∆Q375/K167R/H16L/K159R)中,其对NADP的催化效率(kcat/Km)提高了75倍。CdFDH-M4在多种不对称氧化还原过程中表现出色,其辅酶总周转数(TTN)范围从135增至986,使其具备潜力能够用于需要NADPH的生物催化反应。

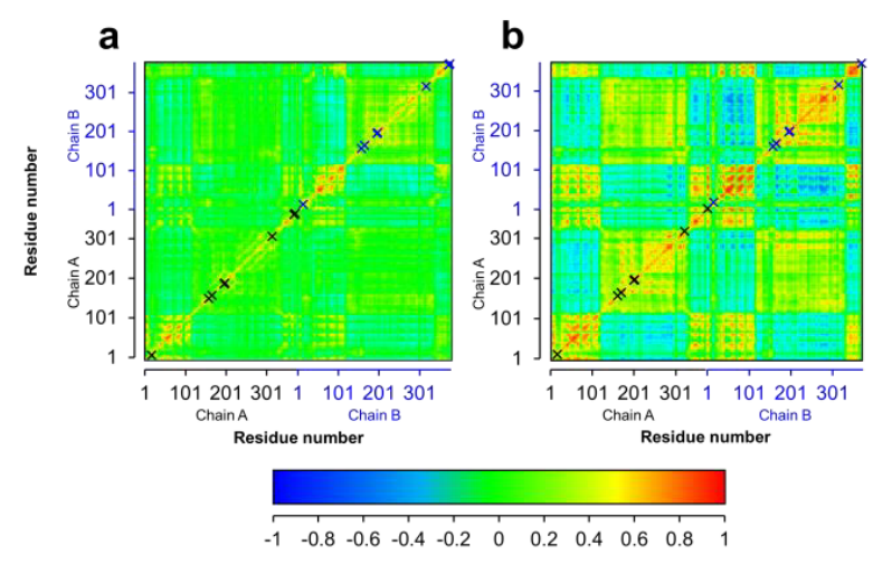
图2. 野生型和突变体M4辅因子结合环境比较
之后,该团队以2.3 Å的分辨率成功得到了最佳突变体CdFDH-M4与NADP的共结晶(PDB:8J3P)。研究发现,与野生型相比,烟酰胺辅酶的结合环境发生了巨大的变化,因此导致了更好的NADP适应性。突变位点D197Q、Y198R和Q199N,CdFDH-M4在NAD(H)核糖的羟基附近提供了更大的空间,以容纳的磷酸基团,突变位点Gln197、Arg198和Asn199残基与NAD(P)H的磷酸基团也形成了氢键网络。此外,突变位点A372S则引入了全新的氢键网络(图2),并且,来自另一个亚基的Lys3与NAD(P)H的磷酸基团支持了额外的极性接触,而在野生型酶中没有观察到这种情况。
总之,这项研究成功改造了一种高效的NADP依赖的FDH突变体(CdFDH-M4),为烟酰胺辅酶的再生提供了有力支持。CdFDH-M4具有良好的NADP利用能力,能够支持不同类型NADPH依赖的生物催化反应。结构分析和分子动力学研究揭示了突变位点在促进底物/辅酶结合以及FDH催化循环转化方面的关键作用。同时,研究也为扩展NADPH再生系统提供了有价值的示例,为改进该FDH超家族的辅因子偏好性提供了启发。
相关新闻


 ENGLISH
ENGLISH